रासायनिक आबंधन – आबंध ध्रुवणता या बन्ध की ध्रुवता से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।आबंध ध्रुवता या बंध की ध्रुवता
- आबंध ध्रुवणता या बन्ध की ध्रुवता ( Polarity of Bonds )
- द्विध्रुव आघूर्ण ( Dipole moment )
- द्विध्रुव आघूर्ण के उपयोग
जैसे महत्वपूर्ण टॉपिक से संबंधित सभी महत्वपूर्ण जानकारी है।
आबंध ध्रुवणता या बन्ध की ध्रुवता ( Polarity of Bonds )
जब दो समान परमाणुओं के बीच ( जैसे- H2 , O2 , Cl2, N2 तथा F2 ) सहसंयोजी आबंध बनता है , तब साझित इलेक्ट्रॉन युग्म दोनों परमाणुओं द्वारा समान रूप से आकर्षित होता है । इससे यह इलेक्ट्रॉन युग्म दोनों नाभिकों के बीच में रहता है । इस प्रकार के आबंध को ‘ अध्रुवीय सहसंयोजी आबंध ‘ कहते हैं ।
लेकिन HF जैसे विषम परमाणुक अणु में दो परमाणुओं के बीच साझित इलेक्ट्रॉन युग्म अधिक विद्युत ऋणी परमाणु फ्लुओरीन की ओर विस्थापित हो जाता है । इस प्रकार के आबंध को ध्रुवीय सहसंयोजक आबंध कहते हैं ।
दो परमाणुओं के मध्य विद्युत ऋणता में अन्तर बढ़ने पर अणु की ध्रवुता भी बढ़ती है तथा ध्रुवता के कारण ऐसे अणु में द्विध्रुव आघूर्ण उत्पन्न हो जाता है ।
द्विध्रुव आघूर्ण ( Dipole moment ) –
किसी ध्रुवीय अणु में आवेश के मान तथा आवेशों के बीच की दूरी के गुणनफल को द्विध्रुव आघूर्ण कहते हैं ।
द्विध्रुव आघूर्ण (μ) = आवेश ( Q ) × ( d ) आवेशों के बीच की दूरी
द्विध्रुव आघूर्ण का मात्रक डिबाए D ( Debye ) है ।
1 D = 3.33 x 10-30 C-m जहाँ C = कूलाम
सममित बहुपरमाण्विक अणु ध्रुवीय नहीं होते , इसलिए इनके द्विधुव आघूर्ण का कोई मान नहीं होता है ।
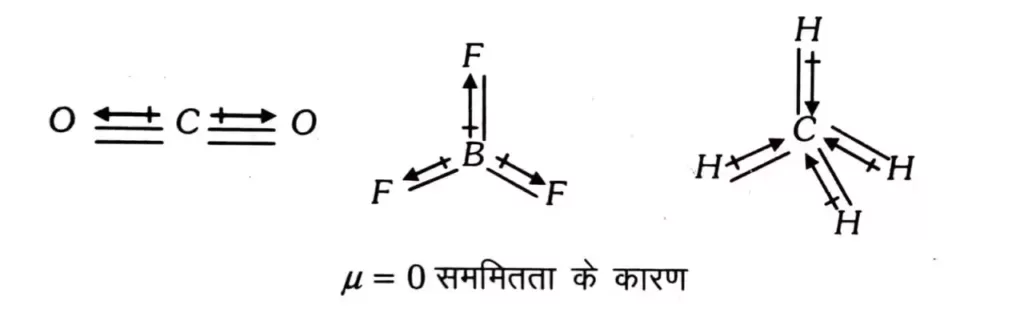
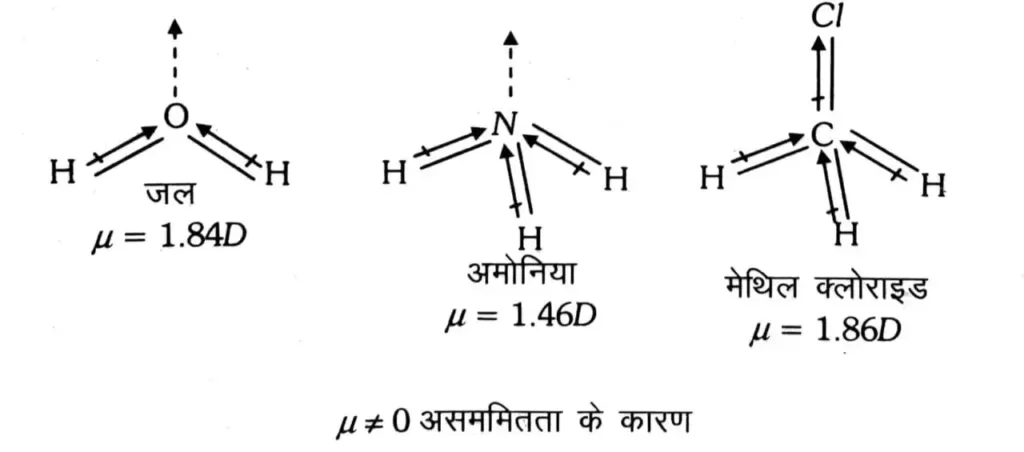
असममित बहुपरमाण्विक अणु : द्विध्रुव आघूर्ण का हमेशा कुछ न कुछ मान होता है । अणु ; जो कि प्रकृति में ध्रुवीय हैं जैसे H2O , CH3CI , NH3; आदि में द्विध्रुव आघूर्ण का एक निश्चित धनात्मक मान होता है ।
द्विध्रुव आघूर्ण के उपयोग
अणुओं की ज्यामिति ज्ञात करने में :
( i ) CO2 , CS2 अणु रेखीय होते हैं क्योंकि उनके द्विध्रुव आघूर्ण का मान शून्य होता है ।
( ii ) H2O , NH3 चतुष्फलकीय नहीं होते क्योंकि उनमें द्विध्रुव आघूर्ण होता है ।

Thanks
Thanks for your blog, nice to read. Do not stop.