कार्बनिक यौगिकों की आकृतियाँ | संरचनात्मक निरूपणक से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।
केकुले के अनुसार कार्बन परमाणु चतुर्संयोजी होता है तथा यह अन्य कार्बन परमाणुओं के साथ जुड़कर विवृत श्रृंखला (Open Chain ) तथा संवृत श्रृंखला ( Close Chain ) यौगिक बना सकता है ।
कार्बन के इस गुण को श्रृंखलन कहते हैं ।
कार्बनिक यौगिकों की आकृतियाँ
( Shapes of Organic Compounds )
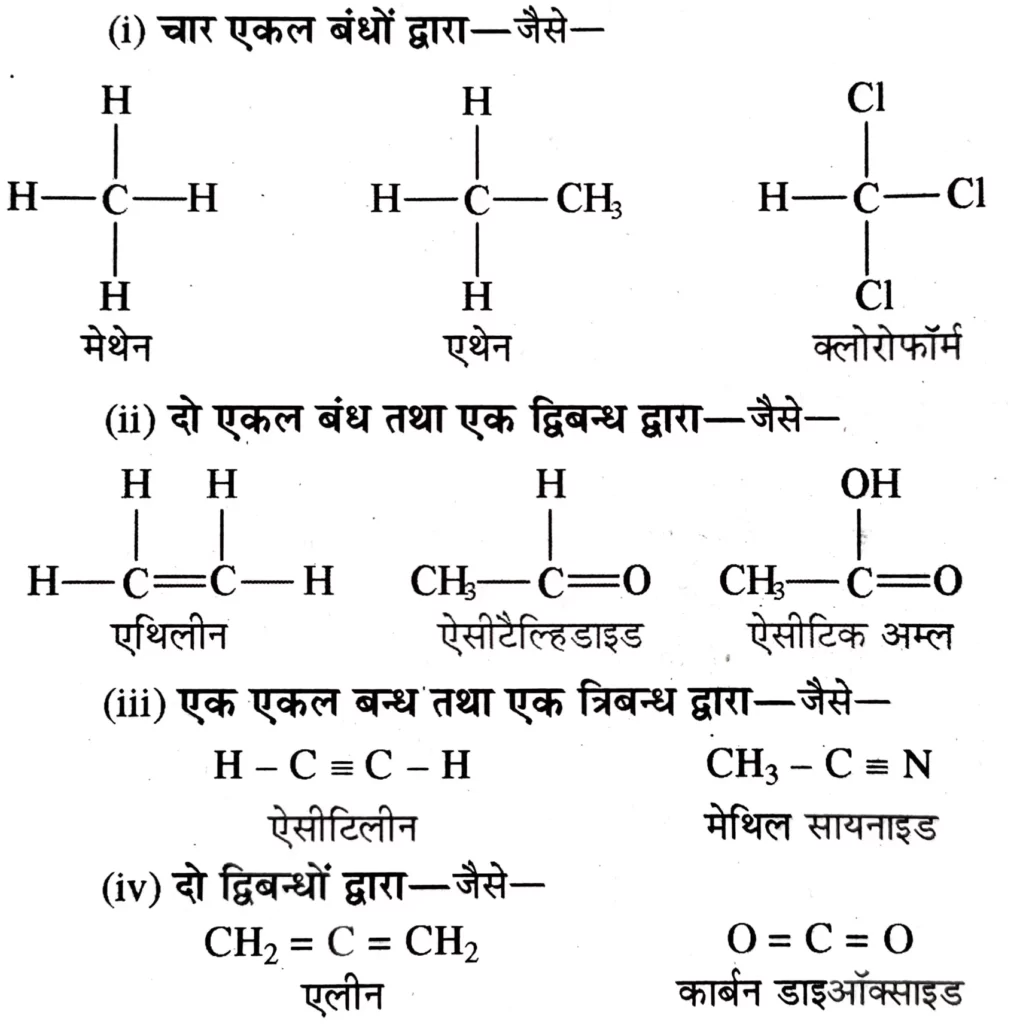
कार्बन परमाणु अन्य कार्बन परमाणुओं या दूसरे तत्वों के परमाणुओं के साथ एकल , द्वि या त्रिबन्ध द्वारा बन्धित हो सकता है । कार्बन की चार संयोजकताएँ निम्नलिखित चार प्रकार से पूर्ण हो सकती हैं
लेबैल तथा वान्ट हॉफ का सिद्धान्त
ले बैल तथा वान्ट हॉफ के अनुसार कार्बन की चारों संयोजकताएं एक समचतुष्फलक ( Tetrahedron ) के चारों कोनों की ओर निर्देशित होती है तथा कार्बन परमाणु इस चतुष्फलक के केन्द्र पर स्थित होता है ।
कार्बन के चारों बन्ध एक – दूसरे के साथ 109°28′ का कोण बनाते हैं जिसे बंध कोण ( Bond angle ) कहते हैं । कार्बन की चारों संयोजकताएँ समान होती हैं ।
कार्बनिक यौगिक में किसी परमाणु पर संकरण ज्ञात करना
कार्बनिक यौगिक में किसी परमाणु की संकरित अवस्था σ तथा π बन्धों की संख्या पर निर्भर करती है । जब किसी परमाणु पर 4σ बन्ध होते हैं तो उस पर sp3 संकरण , 3σ बन्ध होने पर sp2 संकरण व 2σ बन्ध होने पर sp संकरण होता है ।
कार्बनिक यौगिकों का संरचनात्मक निरूपण
Structural Representation of Organic Compounds
लघु आबन्ध संरचना या पूर्ण संरचना सूत्र – किसी यौगिक के पूर्ण संरचना सूत्र को लिखने के लिए इलेक्ट्रॉन युग्म सहसंयोजक बन्ध रेखा ( dash ) ( – ) द्वारा दर्शाया जाता है अतः इसे लघु आबन्ध को लघु संरचना भी कहा जाता है ।
एकल आबंध , द्विआबंध तथा त्रिआबंध को क्रमश : एक लघु रेखा ( – ) , दो लघु रेखा ( = ) तथा तीन लघु रेखा ( = ) द्वारा दर्शाया जाता है ।
विषम परमाणुओं ( जैसे- ऑक्सीजन , नाइट्रोजन , सल्फर , हैलोजेन इत्यादि ) पर उपस्थित एकाकी इलेक्ट्रॉन – युग्म को दो बिन्दुओं ( .. ) द्वारा दर्शाया जाता हैं । उदाहरण
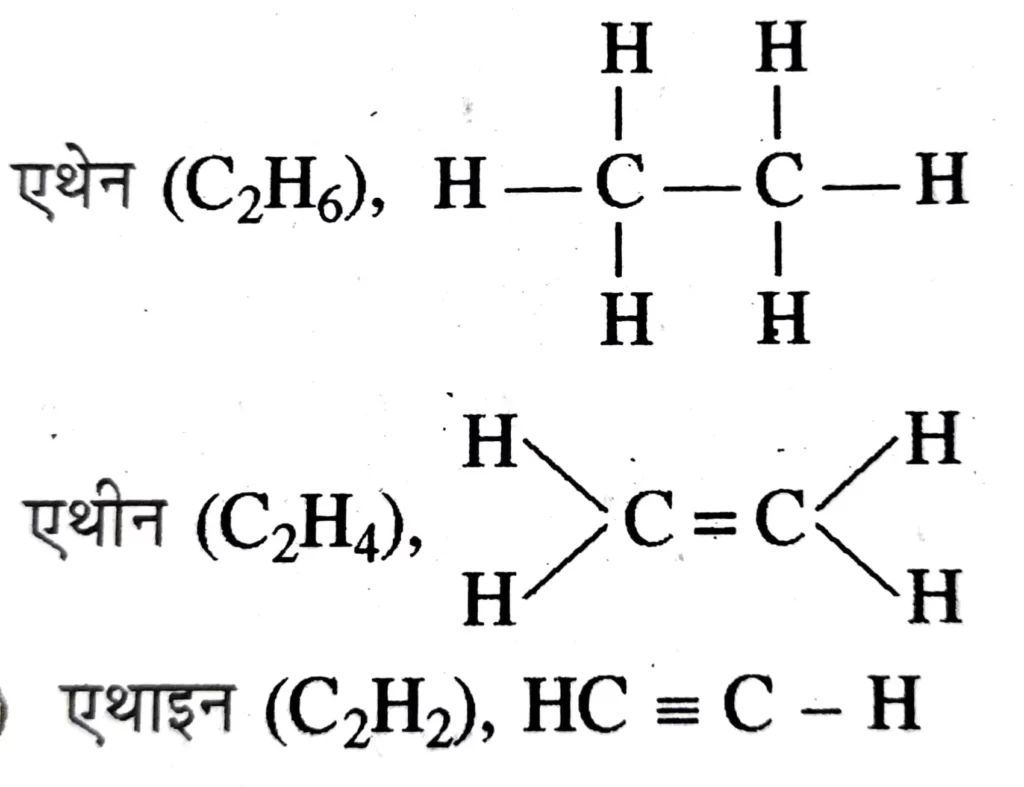
जब अणु में उपस्थित सभी बन्धों को दर्शाया जाता है तो इसे विस्तारित संरचना सूत्र भी कहते है ।
संघनित संरचना– किसी यौगिक की संघनित संरचना लिखने के लिए उसके कुछ या सारे सहसंयोजक आबन्धों को हटाकर , एक परमाणु से जुड़े समान समूहों को कोष्ठक में लिखकर उनकी संख्या प्रदर्शित किया जाता है ।
उदाहरण – एथेन CH3CH3 , ऐथीन CH2 = CH2 , एथेनॉल CH3CH2OH , ऑक्टेन CH3CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3 या CH3(CH)6 – CH3
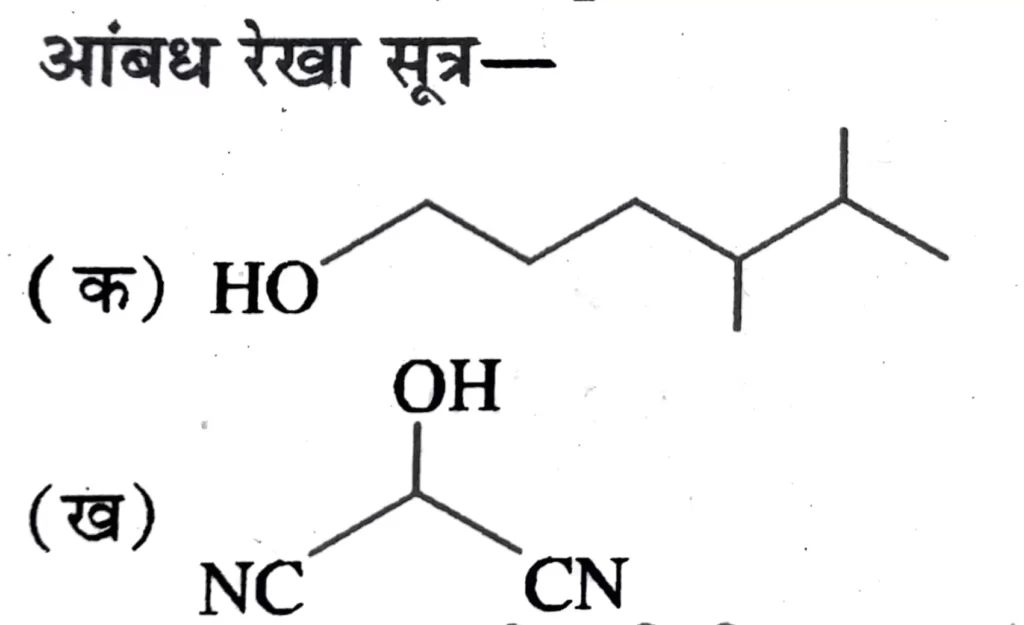
आबन्ध रेखा संरचना– किसी यौगिक के आबंध रेखा संरचनात्मक सूत्र में कार्बन तथा हाइड्रोजन परमाणुओं को नहीं लिखा जाता है ।
कार्बन – कार्बन आबंधों को टेढ़ी – मेढ़ी ( Zig – zag ) रेखाओं द्वारा प्रदर्शित किया जाता है । इसमें एकल बन्ध को एक रेखा , द्विबन्ध को दो रेखाओं तथा त्रिबन्ध को तीन रेखाओं द्वारा दर्शाते हैं ।
केवल ऑक्सीजन ,क्लोरीन , नाइट्रोजन इत्यादि परमाणुओं को लिखा जाता है ।
आबन्ध रेखा संरचना में सिरे पर स्थित रेखा मेथिल ( –CH3 ) समूह को दर्शाती है । ( जब तक कि इस पर किसी क्रियात्मक समूह को नहीं दर्शाया गया हो ) आंतरिक रेखाएँ उन कार्बन परमाणुओं को दर्शाती हैं , जो अपनी संयोजकता को पूर्ण करने के लिए आवश्यक हाइड्रोजन से बंधित होते है ।
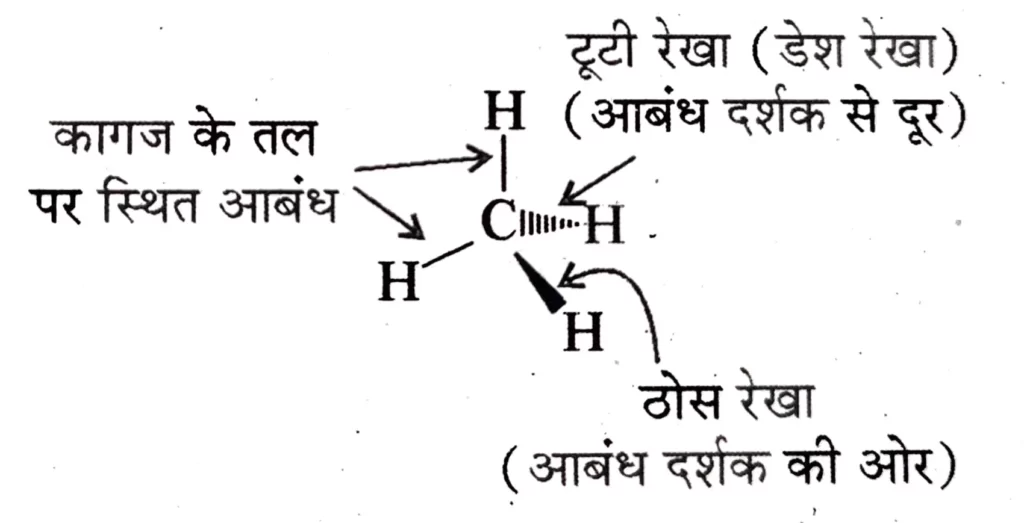
कार्बनिक यौगिकों का त्रिविमिय सूत्र
Three Dimensional Formula of Organic Compounds
पेपर पर कार्बनिक यौगिकों के त्रिविमीय ( 3D ) सूत्र को दर्शाने के लिए कुछ परिपाटियों ( Conventions ) का प्रयोग किया जाता है ।
उदाहरण-द्विविमीय संरचना को त्रिविमीय संरचना में देखने के लिए ठोस तथा डैश वेज सूत्र का प्रयोग किया जाता है ।
त्रिविमीय सूत्रों में ठोस वेज उस बंध को दर्शाता है , जो कागज के तल से दर्शक की ओर प्रक्षेपी ( Projected ) है तथा डैश वेज विपरीत दिशा में , अर्थात् दर्शक से जाने वाले बंध को प्रदर्शित करता है ।
कागज के तल में स्थित बंध को साधारण रेखा (-) द्वारा दर्शाया जाता है ।
मेथेन अणु का त्रिविमीय सूत्र