रासायनिक आबंधन – [ VSEPR ] संयोजी कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धान्त Valence shell electron pair repulsion theory से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।
- संयोजी कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धान्त
- VSEPR सिद्धान्त की मुख्य अवधारणाएं
- केंद्रीय परमाणु पर एकाकी युग्म रहित अणुओं की आकृति
- केंद्रीय परमाणु पर एकाकी युग्म युक्त अणुओं की आकृति
जैसे महत्वपूर्ण टॉपिक से संबंधित सभी महत्वपूर्ण जानकारी है।
संयोजी कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धान्त
Valence shell electron pair repulsion theory
लूइस अवधारणा से अणुओं की आकृति की व्याख्या करना संभव नहीं है । संयोजकता कोश इलेक्ट्रॉन युग्म प्रतिषण ( VSEPR ) सिद्धान्त की सहायता से सहसंयोजी अणुओं की आकृति को सरलता से समझाया जा सकता है ।
VSEPR सिद्धान्त सर्वप्रथम सिजविक तथा पॉवेल ने 1940 में दिया था । इसके बाद 1957 में नाइहोम तथा गिलेस्पी ने इसको विकसित करके इसमें कुछ संशोधन किए । यह सिद्धान्त परमाणुओं के संयोजकता कोश में उपस्थित इलेक्ट्रॉन युग्मों के मध्य प्रतिकर्षण पर आधारित है ।
यह सिद्धान्त सिजविक ( Sidgwick ) व पॉवेल ( Powell ) ( 1940 ) नामक वैज्ञानिक ने अणु की आकृति व ज्यामिति को स्पष्ट करने के लिए दिया था । इस सिद्धान्त के अनुसार केन्द्रीय परमाणु के चारों ओर बन्धों की व्यवस्था इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण ( बन्धीय व अनआबन्धीय ) पर निर्भर करती है । गिलेस्पी ( Gillespie ) और नायहॉम ( Nyholm ) ने इस सिद्धान्त को विकसित किया व इसे VSEPR कहा ।
VSEPR सिद्धान्त की मुख्य अवधारणाएं
- बहुपरमाण्विक अणु जिनमें 3 या अधिक परमाणु जिस माध्यमिक परमाणु से जुड़े होते हैं उसे केन्द्रीय परमाणु कहते हैं।
- किसी अणु की ज्यामिति वास्तव में एक केन्द्रीय परमाणु के चारों ओर उपस्थित संयोजी कक्षा के इलेक्ट्रॉन युग्म ( बन्धीय या अनआबन्धीय ) की संख्या पर निर्भर करती है इनके प्रतिकर्षण के कारण ही अणु की वास्तविक आकार व आकृति का निर्धारण होता है ।
- यदि केन्द्रीय परमाणु , एक समान परमाणुओं से जुड़ा है तो उनके मध्य प्रतिकर्षण भी लगभग एक सा ही होगा । जिसके कारण अणु की आकृति सममित होगी ।
- यदि केन्द्रीय परमाणु अलग – अलग आकार के परमाणुओं से जुड़ा है या उनके इलेक्ट्रॉन युग्मों व उतने ही बन्ध युग्मों ( इलेक्ट्रॉन के ) से घिरा है तो ऐसे अणु की ज्यामितीय विकृत हो जायेगी ।
- इलेक्ट्रॉन युग्म के प्रतिकर्षण का निम्न क्रम होता है , Ip – Ip > Ip – bp > bp – bp बन्ध युग्म दो बन्धीय परमाणुओं को खींचता है किन्तु केन्द्रीय परमाणु के चारों ओर की व्यवस्था पर इलेक्ट्रॉन युग्म अधिक प्रभाव डालता है । अतः प्रतिकर्षण तभी अधिक होगा जब इलेक्ट्रॉन युग्म उपस्थित होगा ।
VSEPR सिद्धान्त की सहायता से अणुओं की ज्यामिति ज्ञात करने के लिए अणुओं को दो भागों में वर्गीकृत किया जा सकता है
( i ) अणु , जिनके केन्द्रीय परमाणु पर एकाकी युग्म उपस्थित नहीं होता है ।
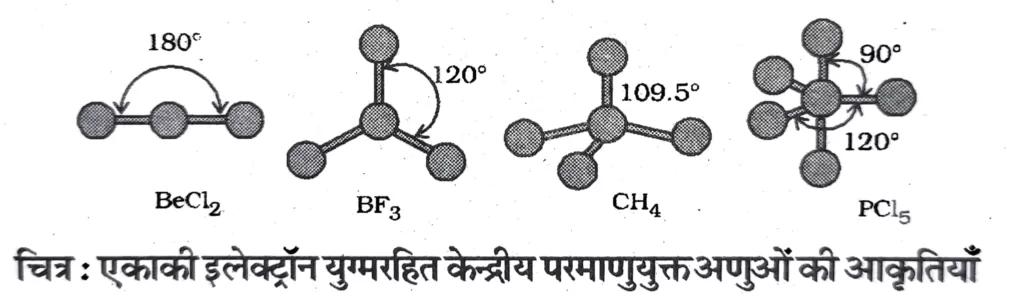
( ii ) अणु , जिनके केन्द्रीय परमाणु पर एक या एक से अधिक एकाकी युग्म उपस्थित होते हैं ।
केंद्रीय परमाणु पर एकाकी युग्म रहित अणुओं की आकृति
| अणु का प्रकार | बंधित इलेक्ट्रॉन युग्मों की संख्या | आबंध कोण | ज्यामिति | उदाहरण |
| AB2 | 2 | 180o | रेखीय | BeCl2,HgCl2,BeH2 |
| AB3 | 3 | 120o | त्रिकोणीय समतलीय | BF3 BCl3 |
| AB4 | 4 | 109.5o | चतुष्फलकीय | CH4 NH4+ CCl4 SiCl4 |
| AB5 | 5 | 90o,120o | त्रिकोणीय द्विपिरामिड | PCl5,PF5 |
| AB6 | 6 | 90o | अष्टफलकीय | SF6 |
| AB7 | 7 | 72o,90o,180o | पंचभुजीय द्विपिरामिड | IF7 |
केंद्रीय परमाणु पर एकाकी युग्म युक्त अणुओं की आकृति
| अणु का प्रकार | BOND PAIR | L.P | बंध कोण | ज्यामिति | उदाहरण |
| AB2E | 2 | 1 | V-SHAPE | 120o | SO2 SnCl2 NO2– |
| AB3E | 3 | 1 | पिरामिड | <109o28′ | NH3 PH3 |
| AB2E2 | 2 | 2 | V-SHAPE | <109o28′ | H2O ,H2S |
| AB4E | 4 | 1 | अनियमित चतुष्फलकीय | <109o28′ | SF4,TeCl4 |
| AB3E2 | 3 | 2 | T-SHAPE | 90o | CLF2 ,IF3 |
| AB2E3 | 2 | 3 | रेखीय | 180o | XeF2 |
| AB5E | 5 | 1 | वर्ग पिरामिड | <90o | BrF5,IF5 |
| AB4E2 | 4 | 2 | वर्गाकार समतलीय | – | XeF4 |
| AB6E | 6 | 1 | विकृत अष्टफलकीय | – | XeF6 |
